„CASS Transformation and Research Lab“ – AG Christian Lamm
Als Teil des CASS-Projekts arbeiten wir im CASS Transformation and Research Lab an der Entwicklung von in vitro-Methoden, um die genetische Transformation landwirtschaftlich nutzbarer Cassava-Genotypen zu ermöglichen, und stellen für unsere Projektpartner routinemäßig gentechnisch veränderte Cassava-Pflanzen her.
Die grüne Gentechnik ist für die moderne Pflanzenforschung und -züchtung unverzichtbar. Sie kann beispielsweise genutzt werden, um die molekularen Funktionen von Enzymen und Proteinen aufzuklären, bestehende Stoffwechselwege zu verbessern oder gänzlich neue einzuführen. Auch moderne Genomeditierungsverfahren wie das CRISPR/Cas-System sind i.d.R. auf klassische gentechnische Methoden angewiesen.
Die langwierigen Verfahren erfordern jedoch eine präzise Abstimmung auf die Versuchspflanze. Tatsächlich lassen sich selbst innerhalb einer Art meist nur wenige Kultivare effizient transformieren, ein Nachteil vor allem bei der gezielten Veränderung von Nutzpflanzen: Zugängliche Kultivare entsprechen nicht notwendigerweise den landwirtschaftlichen Bedürfnissen, zum Beispiel aufgrund geringerer Erträge oder höherer Anfälligkeit für Pathogene oder widrige Umweltbedingungen. Insbesondere das Aufkommen von Genomeditierungsverfahren hat daher dazu geführt, dass in der Forschung Wege gesucht werden, landwirtschaftlich nutzbare Sorten verschiedenster Kulturpflanzen zu transformieren.
In Zeiten des globalen Klimawandels und steigender Bevölkerungszahlen könnte die grüne Gentechnik so, Hand in Hand mit modernen Züchtungsverfahren, einen entscheidenden Beitrag zur dringend notwendigen Sicherstellung der weltweiten Nahrungsmittelsicherheit leisten.
Im Rahmen des CASS-Projekts beschäftigen wir uns in diesem Zusammenhang mit der tropischen Nutzpflanze Cassava, die vor allem von Kleinbauern in Sub-Sahara Afrika wegen ihrer stärkehaltigen Speicherwurzeln angebaut wird. Im internationalen Vergleich werden hier jedoch drastisch niedrigere Erträge erzielt, unter anderem wegen mangelnder Verfügbarkeit von Düngemitteln, Bioziden und modernen landwirtschaftlichen Geräten. Eine biotechnologische Anpassung zur Ertragsstabilisierung bei niedrigem Input ist daher unser erklärtes Ziel.
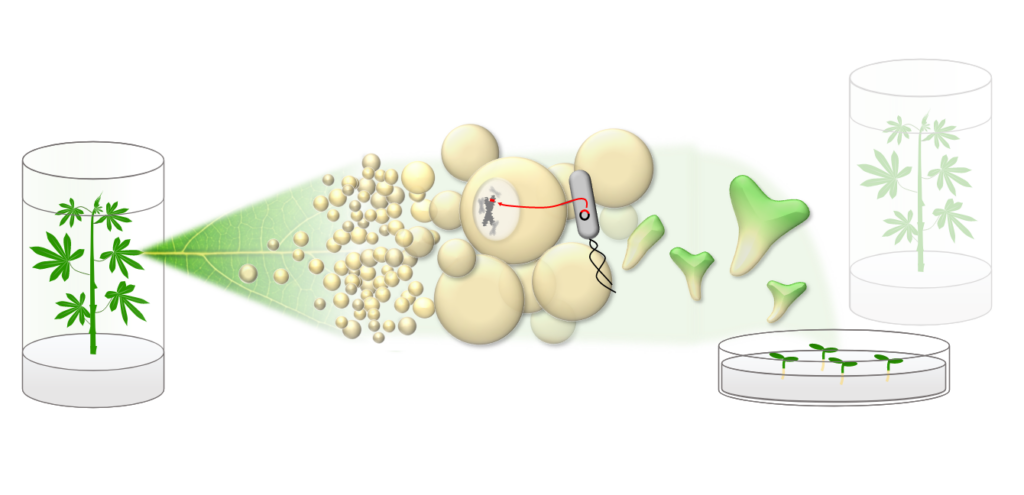
Abbildung 1: Schematische Darstellung der genetischen Transformation von Cassava: Blattexplantate werden genutzt, um eine Kalluskultur anzulegen. In die Zellen lässt sich durch Agrobacterium-vermittelte Transformation gezielt DNA einschleusen. Durch Änderung des Nährmediums durchlaufen die Zellen eine Embryogenese und können zu vollwertigen, transgenen Pflanzen regeneriert werden.

Im CASS Transformation and Research Lab beschäftigen wir uns mit der Weiterentwicklung der genetischen Transformation von Cassava, um landwirtschaftlich relevante Genotypen gentechnisch verändern zu können. Wir untersuchen dabei unter anderem den Nutzen chemischer Medienzusätze, die durch verschiedene Wirkmechanismen, z.B. auf epigenetischer Ebene, das Entwicklungsprogramm der pflanzlichen Zellen verändern und so eine Transformation und/oder Regeneration erleichtern bzw. ermöglichen sollen.
Zudem arbeiten wir mit genetischen Elementen, die gleichermaßen den Transformations- und Regenerationsprozess unterstützen. So kann die Expression bestimmter Entwicklungsregulatoren genutzt werden, bisher nicht transformierbare Kultivare gentechnisch zu verändern – ein Prinzip, dass andere Arbeitsgruppen bereits erfolgreich in Nutzpflanzen wie Mais einsetzen.

Neben diesen Forschungsfragen führen wir auch Routine-Transformationen des Cassava Modellgenotyps TMS60444 für unsere Projektpartner durch (Abbildung 1).
Dabei übernehmen wir den gesamten Arbeitsablauf: Cassava Pflanzen werden unter sterilen Bedingungen angezogen und mit Phytohormonen behandelt, um dedifferenziertes Kallusgewebe zu erzeugen. Ein geeignetes, durch molekulare Klonierung erzeugtes Transformationsplasmid wird durch Elektroporation in einen Laborstamm des Bodenbakteriums Agrobacterium tumefaciens eingeschleust.
Das Bakterium ist bereits natürlicherweise in der Lage, Erbgut in pflanzliche Zellen einzubringen, und durch Kultivierung mit dem Kallusgewebe kann so ein gezielter Transfer der gewünschten DNA erfolgen.
Durch Änderung in der Medienzusammensetzung können schließlich wieder vollwertige Pflanzen regeneriert werden, die das gewünschte genetische Material in das eigene Genom integriert haben (Abbildung 2).
Nach molekularer Bestätigung der genomischen Integration werden die Pflanzen schließlich vegetativ vermehrt und können weiter analysiert werden (Abbildung 3, 4).